Значение в быту и производстве
Применение теплопроводности при строительстве
У каждого материала имеется свой показатель теплопроводности. Чем ее значение ниже, тем, соответственно ниже уровень теплообмена между внешней и внутренней средой. Это означает то, что в здании, сооруженном из материала с низкой теплопроводностью, зимой будет тепло, а летом прохладно.
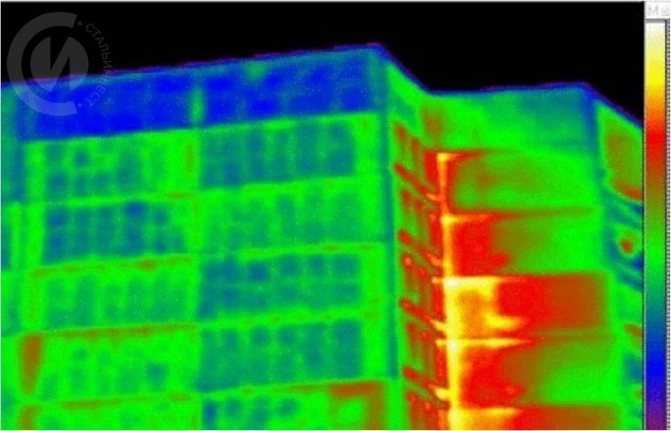
Тепловые потери по швам панельного дома
При сооружении различных зданий, в том числе и жилые здания, без знаний о теплопроводности стройматериалов не обойтись. При проектировании строительных сооружений необходимо учитывать данные о свойствах таких материалов как – бетон, стекло, минеральная вата и многих других. Среди них предельная теплопроводность принадлежит бетону, между тем, у древесины она в 6 раз меньше.
Системы отопления
Ключевая задача любой отопительной системы – это перенос тепловой энергии от теплоносителя в помещения. Для такого обогрева применяют батареи или радиаторы отопления. Они необходимы для передачи тепловой энергии в помещения.
- Радиатор отопления – это конструкция внутри, которой перемещается теплоноситель. К основным характеристикам этого изделия относят: материал, из которого оно изготовлено;
- вид конструкции;
- размеры, в том числе и количество секций;
- показатели теплоотдачи.
Именно теплоотдача и есть ключевой параметр. Все дело в том, что определяет объем энергии, которое передается от радиатора в помещение. Чем больше этот показатель, тем ниже будут потери тепла. Существуют справочные таблицы, определяющие материалы, оптимальные для использования в отопительных системах. Из данных, которые в них размещены, становится ясно, что самым эффективным материалом считается медь. Но, вследствие ее высокой цены и определенных технологических сложностей, связанных с обработкой меди их применяемость не так высока.

Именно поэтому все чаще применяют модели, изготовленные из стальных или алюминиевых сплавов. Нередко применяют и сочетание различных материалов, например, стали и алюминия. Каждый изготовитель радиаторов, при маркировке готовых изделий должен указывать такую характеристику, как мощность тепловой отдачи. На рынке отопительных систем можно приобрести радиаторы, изготовленные из чугуна, стали, алюминия и биметалла.
Чем металлы отличаются друг от друга
Многие не знают, чем металлы отличаются от металлов. Их различия можно классифицировать:
- Металлы между собой отличаются по цвету, как, например, золото и медь.
- Также металлы плавятся при разных температурах. Некоторые металлы, например, олово и свинец, можно расплавить в домашних условиях, а вот для остальных нужна более высокая температура.
- Между собой металлы делятся на две группы: тяжелые и легкие. К тяжелым металлам относятся те, чья плотность составляет от 5 г/см3, легкие металлы имеют плотность меньше 5 г/см3. К легким металлам относится литий, который имеет плотность 0.2 г/см3, место самого тяжелого металла делят между собой осмий и иридий. Их плотность составляет 22.6 г/см3.
- Металлы отличаются друг от друга пластичностью и электропроводность. Некоторые из них очень пластичны. К примеру, из всего лишь 1 грамма золота можно сделать тонкую проволоку в 3.5 километра. Она будет гибкой и не сломается. Повторить такое с менее пластичным металлом не получится.
- Также часть металлов проводит ток лучше, чем другие. Самыми электропроводными металлами признаны медь, серебро и алюминий. Их наиболее часто применяют в качестве проводящих элементов.
Общие физические свойства
Существуют общие физические свойства металлов. К ним относятся:
- Пластичность.
- Характерный блеск.
- Электропроводность.
- Высокая теплопроводность.
- Все, кроме ртути, находятся в твердом состоянии.
Следует понимать, что свойства металлов очень различаются относительно их химической или физической сути. Некоторые из них мало похожи на металлы в обыденном понимании этого термина. Например, ртуть занимает особенное положение. Она при обычных условиях находится в жидком состоянии, не имеет кристаллической решетки, наличию которой обязаны своими свойствами другие металлы. Свойства последних в этом случае условны, с ними ртуть роднят в большей степени химические характеристики.
Интересно!
Элементы первой группы, щелочные металлы, в чистом виде не встречаются, находясь в составе различных соединений.
Самый мягкий металл, существующий в природе — цезий — относится к этой группе. Он, как и другие щелочные подобные вещества, мало общего имеет с более типичными металлами. Некоторые источники утверждают, что на самом деле, самый мягкий металл калий, что сложно оспорить или подтвердить, поскольку ни тот, ни другой элемент не существует сам по себе — будучи выделенным в результате химической реакци они быстро окисляются или вступают в реакцию.
Вторая группа металлов — щелочноземельные — намного ближе к основным группам. Название «щелочноземельные» происходит из древних времен, когда окислы назывались «землями», поскольку они имеют рыхлую рассыпчатую структуру. Более-менее привычными (в обиходном смысле) свойствами обладают металлы начиная с 3 группы. С увеличением номера группы количество металлов убывает
Дмитрий Менделеев смог создать уникальную таблицу химических элементов, главным достоинством которой была периодичность. Металлы и неметаллы в таблице Менделеева располагаются так, что их свойства изменяются периодическим образом.
Периодическая система была составлена Дмитрием Менделеевым во второй половине 19 века. Открытие не только позволило упростить работу химиков, она смогла объединить в себе как в единой системе все открытые химические вещества, а также предсказать будущие открытия.
Создание данной структурированной системы бесценно для науки и для человечества в целом. Именно это открытие дало толчок развитию всей химии на долгие годы.
В интервью одному журналисту ученый объяснил, что работал над ней 25 лет и то, что она ему снилась – вполне естественно, но это не значит, что во сне пришли все ответы.
Созданная Менделеевым система делится на две части:
- периоды – столбики по горизонтали в одну или две строки (ряды);
- группы – вертикальные строчки, в один ряд.

Всего в системе 7 периодов, каждый следующий элемент отличен от предыдущего большим количеством электронов в ядре, т.е. заряд ядра каждого правого показателя больше левого на единицу. Каждый период начинается с металла, а заканчивается инертным газом – именно это и есть периодичность таблицы, ведь свойства соединений меняются внутри одного периода и повторяются в следующем
. При этом, следует помнить, что 1-3 периоды неполные или малые, в них всего 2, 8 и 8 представителей. В полном периоде (т.е. оставшихся четырех) по 18 химических представителей.
 В группе располагаются химические соединения с одинаковой высшей , т.е. у них одинаковое электронное строение. Всего в системе представлено 18 групп (полная версия), каждая из которых начинается щелочью и заканчивается инертным газом. Все, представленные в системе субстанции, можно разделить на две основные группы – металл или неметалл.
В группе располагаются химические соединения с одинаковой высшей , т.е. у них одинаковое электронное строение. Всего в системе представлено 18 групп (полная версия), каждая из которых начинается щелочью и заканчивается инертным газом. Все, представленные в системе субстанции, можно разделить на две основные группы – металл или неметалл.
Для облегчения поиска группы имеют свое название, а металлические свойства субстанций усиливаются с каждой нижней строчкой, т.е. чем ниже соединение, тем больше у него будет атомных орбит и тем слабее электронные связи. Также меняется и кристаллическая решетка – она становится ярко выраженной у элементов с большим количеством атомных орбит.
В химии используют три вида таблиц:
- Короткая – актиноиды и лантаноиды вынесены за границы основного поля, а 4 и все последующие периоды занимают по 2 строчки.
- Длинная – в ней актиноиды и лантаноиды вынесены за границу основного поля.
- Сверхдлинная – каждый период занимает ровно 1 строку.
Главной считается та таблица Менделеева, которая была принята и подтверждена официально, но для удобства чаще используют короткую версию. Металлы и неметаллы в таблице Менделеева располагаются согласно строгим правилам, которые облегчают работу с ней.
Металлы в таблице Менделеева
В системе Менделеева сплавы имеют преобладающее число и список их весьма велик – они начинаются с Бора (В) и заканчиваются полонием (Po) (исключением являются германий (Ge) и сурьма (Sb)). У этой группы есть характерные признаки, они разделены на группы, но их свойства при этом неоднородны. Характерные их признаки:
- пластичность,
- электропроводимость,
- блеск,
- легкая отдача электронов,
- ковкость,
- теплопроводность,
- твердость (кроме ртути).
Из-за различной химической и физической сути свойства могут существенно отличаться у двух представителей этой группы, не все они похожи на типичные природные сплавы, к примеру, ртуть – это жидкая субстанция, но относится к данной группе.
В обычном своем состоянии она жидкая и без кристаллической решетки, которая играет ключевую роль в сплавах. Только химические характеристики роднят ртуть с данной группой элементов, несмотря на условность свойств этих органических соединений. То же самое касается и цезия – самого мягкого сплава, но он не может в природе существовать в чистом виде.
Некоторые элементы такого типа могут существовать только доли секунды, а некоторые не встречаются в природе совсем – их создали в искусственных условиях лаборатории. У каждой из групп металлов в системе есть свое название и признаки, которые отличают их от других групп.
При этом отличия у них весьма существенные. В периодической системе все металлы располагаются по количеству электронов в ядре, т.е. по увеличению атомной массы. При этом для них характерно периодическое изменение характерных свойств. Из-за этого в таблице они не размещаются аккуратно, а могут стоять неправильно.
В первой группе щелочей нет веществ, которые бы встречались в чистом виде в природе – они могут пребывать только в составе различных соединений.
Как отличить металл от неметалла?
Как определить металл в соединении? Существует простой способ определения, но для этого необходимо иметь линейку и таблицу Менделеева. Для определения надо:
- Провести условную линию по местам соединения элементов от Бора до Полония (можно до Астата).
- Все материалы, которые будут слева линии и в побочных подгруппах – металл.
- Вещества справа – другого типа.
Однако у способа есть изъян – он не включает в группу Германий и Сурьму и работает только в длинной таблице. Метод можно использовать в качестве шпаргалки, но чтобы точно определить вещество, следует запомнить список всех неметаллов. Сколько их всего? Мало – всего 22 вещества.
В любом случае, для определения природы вещества необходимо рассматривать его в отдельности. Легко будет элементы, если знать их свойства
Важно запомнить, что все металлы:
- При комнатной температуре – твердые, за исключением ртути. При этом они блестят и хорошо проводят электрический ток.
- У них на внешнем уровне ядра меньшее количество атомов.
- Состоят из кристаллической решетки (кроме ртути), а все другие элементы имеют молекулярную или ионную структуру.
- В периодической системе все неметаллы – красного цвета, металлы – черного и зеленого.
- Если двигаться слева направо в периоде, то заряд ядра вещества будет увеличиваться.
- У некоторых веществ свойства выражены слабо, но они все равно имеют характерные признаки. Такие элементы относятся к полуметаллам, например Полоний или Сурьма, они обычно располагаются на границе двух групп.
Важно запомнить, что при перемещении в таблице сверху вниз становятся сильнее неметаллические свойства веществ, поскольку там располагаются элементы, которые имеют отдаленные внешние оболочки. Их ядро отделено от электронов и поэтому они притягиваются слабее
Физические свойства неметаллов
Общая характеристика неметаллов
А) Положение неметаллов в периодической системе
— НЕМЕТАЛЛЫ VIII ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (БЛАГОРОДНЫЕ ГАЗЫ):гелий, неон, аргон, криптон, ксенон, радон.
— НЕМЕТАЛЛЫ VII ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (ГАЛОГЕНЫ):фтор,хлор, бром, йод, астат.
— НЕМЕТАЛЛЫ VIГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (ХАЛЬКОГЕНЫ):кислород, сера, селен, теллур.
— НЕМЕТАЛЛЫ V ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (ПОДГРУППА АЗОТА):азот, фосфор, мышьяк.
— НЕМЕТАЛЛЫ IVГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (ПОДГРУППА УГЛЕРОДА):углерод, кремний.
Б) Особенности атомного строения неметаллов:
1. Небольшой атомный радиус;
2. На внешнем уровне 4-8 электронов (исключение водород – 1 электрон, гелий – 2 электрона);
3. Характерно высокое значение ЭО;
4. Степени окисления от -4 до +8.
В) Строение простых веществ неметаллов
Неметаллы-простые вещества, образованные элементами неметаллами и обладающие характерными неметаллическими свойствами: отсутствие металлического блеска, неэлектропроводность и т.д.
Вид химической связи – ковалентная неполярная.
Тип кристаллической решётки – атомная, молекулярная.
1. АТОМАРНОЕ СОСТОЯНИЕ: Инертные или благородные газы не образуют молекул и существуют в атомарном состоянии (He –гелий, Ne-неон, Ar-аргон , Kr-криптон , Xe-ксенон , Rn-радон
2. АТОМНЫЕ КРИСТАЛЛИЧЕСКИЕ РЕШЁТКИ: алмаз (С) и кремний (Si)
3. МОЛЕКУЛЯРНАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА
Многие неметаллы образуют молекулу, состоящую из двух атомов
(H2, O2, N2, F2, Cl2, Br2, I2)..
Физические свойства неметаллов
При обычной температуре неметаллы могут быть в разном агрегатном состоянии.
1. Газообразные — O2-кислород, H2 — водород, N2- азот, Cl2-хлор, F2-фтор.
2. Жидкие — Br2 -бром
3. Твердые: S8 –ромбическая сера, P4-бедый фосфор, I2- йод, C — алмаз и графит
Многие не проводят электрический ток (кроме графита-C и кремния-Si).
Не проводят тепло.
В твердом состоянии — хрупкие.
Не имеют металлического блеска (кроме иода-I2, графита-C и кремния-Si)
Цвет охватывает все цвета спектра: красный-красный фосфор, желтый –сера, зеленый-хлор, фиолетовый –пары иода.
Температура плавления изменяется в огромном интервале: tпл (N2)= -210⁰C , а tпл (алмаз) =3730⁰С
АЛЛОТРОПИЯ— способность атомов одного химического элемента образовывать несколько простых веществ, а эти простые вещества – аллотропными видоизменениями или модификациями.
КИСЛОРОД
Элемент кислород образует две аллотропные модификации
Кислород — O₂: Газ без цвета и запаха. Входит в состав воздуха (21% по объему). Не ядовит!
Озон — O3: Газ бледно-фиолетового цвета с резким запахом свежести. Ядовит!
Обладает бактерицидными свойствами.
СЕРА
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t кип = 445 °С
У серы можно выделить три аллотропных модификации: кристаллическая(ромбическая), моноклинная и пластическая.
Переход из кристаллической в пластическую происходит при нагревании до температуры кипения при последующем быстром охлаждении.
АЗОТ
Азот – газ без цвета и запаха, плохо растворим в воде. Азот является основной частью воздуха (79% по объѐму).
ФОСФОР
Образует трдве аллотропные модификации.
Фосфор белый P₄(молекулярная кристаллическая решётка )
Мягкое, бесцветное вещество. В темноте светится. Ядовит!
Фосфор красный Pn (атомная кристаллическая решётка) аморфное
полимерное вещество(порошок) тёмно-красного цвета. В темноте не светится, ядовит!
УГЛЕРОД Образует две аллотропные формы.
Алмаз: Тетраэдрическая кристаллическая решетка
Бесцветные кристаллы. Самое твердое вещество в природе. tпл=3730ºC
Графит: Кристаллическая решетка напоминает соты.
Слоистое кристаллическое вещество, жирное на ощупь, непрозрачное,серого цвета.
Откуда появилась великая таблица Мендлеева?
 Памятники Менделееву существуют во всех странах мира
Памятники Менделееву существуют во всех странах мира
К моменту появления периодической таблицы в 1869 году было открыто 63 химических элемента. Все они представлялись в виде хаотического набора, хотя попытки какого-то упорядочения совершались регулярно.
Первой известной публикацией на этот счет стал «закон триад» (1829 год) Иоганна Дёберейнера, однако он дальше понимания связи атомной массы и химических свойств элементов не продвинулся.
Позднее Александр Эмиль Шанкуртуа создал «Теллуров винт» (1862), разместив элементы на винтовой линии. Ему удалось увидеть частое циклическое повторение химических свойств по вертикали.
Самой правдоподобной стала система Юлиуса Лотара Мейера (1864), который смог составить таблицу, упорядочив элементы по свойствам и весам. Увы, он взял за основу периодичности свойств валентность, что оказалось ошибкой.
 Главный конкурент, который подсказал идею: Лотар Мейер
Главный конкурент, который подсказал идею: Лотар Мейер
Менделеев, по собственным словам, занимался проблемой систематизации химических элементов на протяжении 20 лет (а не спонтанно во время сна, вопреки устоявшемуся мнению), перекладывая карточки с названием и свойствами элементов в поиске нужной комбинации.
И в 1869 ему удалось найти ответ, опубликованный в статье журнала Русского химического общества «Соотношение свойств с атомным весом элементов».
 Периодическая таблица Мейера довольно скудна
Периодическая таблица Мейера довольно скудна
Чуть позже идею подхватил Мейер, опубликовав собственную работу с аналогичным результатом. Знал ли он о достижении Менделеева? Незивестно. К тому же он смог организовать лишь 28 элементов
Однако, из-за него в Европе и США Периодическая таблица Менделеева не имеет в названии имени собственного.
Тем не менее, мировое сообщество ученых трижды выдвигало Менделеева лауреатом Нобелевской премии. Увы, ему не удалось стать членом Российской академии наук, а её члены раз за разом отвергали кандидатуру.
Физические свойства неметаллов
Неметаллы – химические элементы, атомы которых стремятся принять чужие электроны. Для них характерны атомные и молекулярные кристаллические решетки. Для атомов неметаллов не характерны общие физические свойства. На данный момент существует 22 неметалла.

Для неметаллов характерен ряд свойств:
- хрупкость (неметаллы нельзя ковать);
- отсутствие блеска;
- непроводимость электрического тока и тепла.
Расположение металлов и неметаллов в периодической таблице Д.И. Менделеева
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы Менделеева. Металлы располагаются ниже диагонали «водород-бор- кремний-мышьяк-теллур-астат», а неметаллы выше.
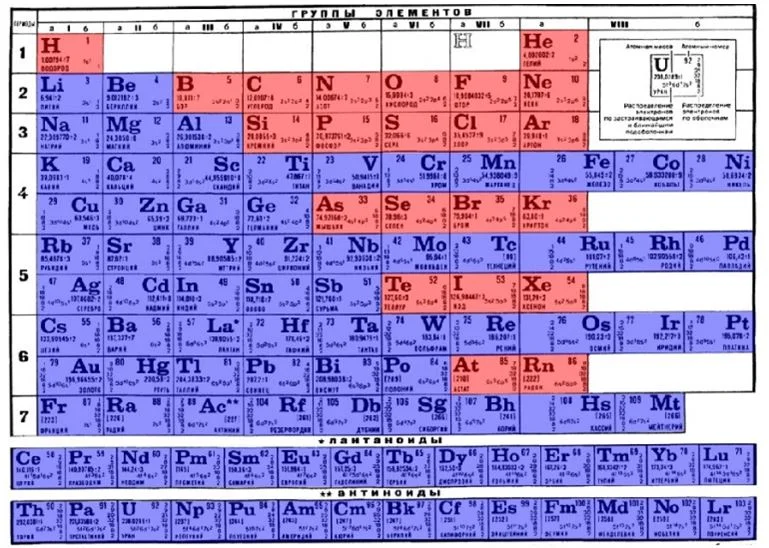
Красные ячейки – неметаллы, синие – металлы
Элементы, расположенные вблизи диагонали, обладают смешанными свойствами: проявляют как металлические, так и неметаллические свойства. Они называются полуметаллами.
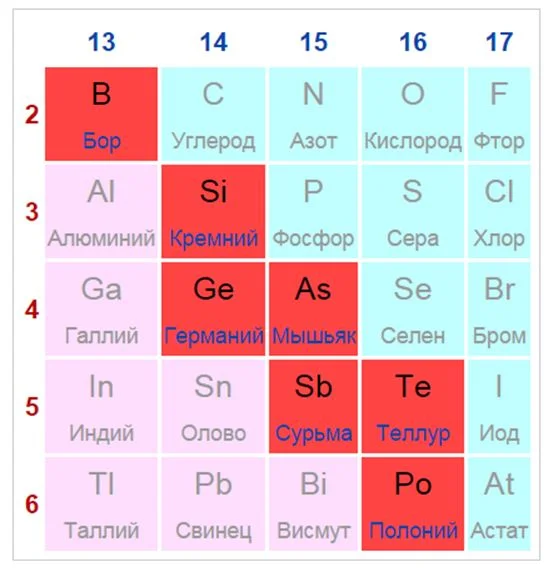
Красные ячейки – полуметаллы
Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности). Валентных электронов у них либо недостаточно для образования полноценной ковалентной связи, либо они не удерживаются достаточно прочно из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер.
Закономерности в таблице Д.И. Менделеева
Каждый атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре, который несет положительный заряд. Вокруг ядра движутся отрицательно заряженные электроны. Атомный номер указывает на количество протонов.
Чем больше заряд ядра, тем сильнее к нему притягиваются электроны. Т.о., атому сложнее отдавать электроны. Поэтому в периоде слева направо, с увеличением порядкового номера металлические свойства ослабевают, а неметаллические – усиливаются.
Неметаллы стремятся принять электроны от других атомов. Период в таблице указывает на количество электронных уровней. По мере увеличения числа орбиталей электроны отдаляются от ядра и атому сложнее удерживать электроны на последних уровнях. Т.о., в группе сверху вниз количество орбиталей возрастает, поэтому металлические свойства усиливаются, а неметаллические – уменьшаются.

Определение металла и его свойства
Каждый день мы имеем дело с металлами и это неспроста. Большинство элементов таблицы Менделеева являются ими. Все они имеют свои характеристики и свойства.
Как правило, металлы — это такие элементы, которые хорошо проводят тепло и электричество. Также металлы очень пластичны, что позволяет изменять их форму путем ковки, еще они имеют высокий коэффициент твердости. Отличительной особенностью этого элемента является блеск, который называется металлическим. Свойства металла делятся на две основные фракции, такие как:
- Физические свойства.
- Химические свойства.
Чем металлы отличаются от металлов по физическим характеристикам? К физическим свойствам относится:
- Цвет. Металлы, как правило, имеют плотную структуру, которая не пропускает сквозь себя свет. А их цвет определяется отражением света от его поверхности. Так, металлы в большинстве случаев имеют расцветку от серого до серебристого. Но есть и исключения, как, например, медь, которая имеет красный цвет, и золото, имеющее желтый окрас.
- Состояние формы, твердость и плотность. Сами по себе металлы имеют твердое агрегатное состояние, но способны переходить в жидкое при высоких температурах. Так, металлы плавятся при температуре от 40 до 3400 градусов по Цельсию. Но встречаются металлы, чье основное агрегатное состояние — жидкое. К таким элементам относят ртуть.
- Электропроводимость. Особенностью является ее снижение при повышении температуры вещества.
- Теплопроводность и температура кипения/плавления.
Чем металлы отличаются от металлов по химическим свойствам? В этой группе выделяют:
- Окисляемость. Также металлы окисляются, и оксидная пленка на поверхности может придать им другой оттенок.
- Вступление в реакцию с неметаллами, кислотами, водой, солями.
Элементы таблицы Менделеева
Существует также класс «металлоподобных» полупроводников с неопределенным состоянием. Благородные газы, не вступающие в реакции, находятся отдельно.
Часть элементов с номерами больше 100 были обнаружены сравнительно недавно, их принадлежность к какой-либо группе является лишь предположением.
Щелочные и щелочноземельные элементы
Представители групп 1 (IA) и 2 (IIA) таблицы Менделеева — металлы с плохой стабильностью и высокой степенью растворимости.
Щелочные металлы имеют серебристый блеск и легко ломаются и режут. Из всех помещенных на столе металлов они активнее других реагируют с молекулами других веществ, отдавая единственный свободный электрон. При контакте с водой образуются гидроксиды – щелочи:
2Na + 2H2O = 2NaOH + H2
Щелочноземельные металлы более твердые и тугоплавкие, с бледно-серым оттенком.
Большинство из них способны создавать щелочь, но их не так легко отделить от двух незанятых электронов. Они заменяют другие металлы, но бессильны против щелочных металлов и вытесняются ими из молекул.
Галогены и благородные газы
Галогены и благородные газы сгруппированы в группы 17 и 18 периодической таблицы. Галогены — неметаллические элементы, все они имеют семь электронов на внешней оболочке. В благородных газах все электроны находятся на внешней оболочке, поэтому практически не участвуют в образовании соединений. Эти газы называются «благородными», потому что они редко реагируют с другими элементами; то есть относится к членам благородной касты, которые традиционно избегали других людей в обществе.
| Галогены | Благородные газы |
| Фтор F 9 | Гелий он 2 |
| Хлор Cl 17 | Неон Неон 10 |
| Бром Бр 35 | Аргон Ар 18 |
| Йод I 53 | Криптон Кр 36 |
| Астатин в 85 лет | Ксенон Хе 54 |
| — | Радоновый р-н 86 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды представляют собой группу элементов, изначально обнаруженных в редких минералах; отсюда и название «редкоземельные элементы». Впоследствии оказалось, что эти элементы не так редки, как считалось сначала, и поэтому редкоземельным элементам было дано название лантаноиды. Лантаниды и актиноиды занимают два блока, которые расположены ниже основной таблицы элементов. Обе группы включают металлы; все лантаноиды (кроме прометия) не радиоактивны; актиниды, с другой стороны, радиоактивны.
| Лантаноиды | Актиниды |
| Лантан Ла 57 | Актиний Ac 89 |
| Церий Се 58 | Торий Th 90 |
| Празеодим Пр 59 | Протактиний Па 91 |
| Неодим Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий См 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Ам 95 |
| Гадолиний Бог 64 | Кюриум см 96 |
| Тербий Тб 65 | Берклиум Бк 97 |
| Диспрозий Dy 66 | Калифорния cf 98 |
| Гольмий Хо 67 | Эйнштейний 99 |
| Эрбий Er 68 | Ферми FM 100 |
| Тулий Тм 69 | Менделевий Мд 101 |
| Иттербий Yb 70 | Нобелий № 102 |
Неметаллы
Из всех элементов, отнесенных к неметаллам, водород принадлежит к первой группе таблицы Менделеева, а остальные к группам 13-18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно они находятся в газообразном (водород или кислород) или твердом (углерод) состоянии при комнатной температуре).
| Нет металлов |
| Водород H1 |
| C6 углерод |
| Азот №7 |
| Кислород О8 |
| Фосфор Р 15 |
| Сера S16 |
| Селен Se 34 |
| Флеровиум Фл 114 |
| Унунсептиус Уус 117 |
Металлоиды
Металлоиды занимают 13-16 группы периодической таблицы. Металлоиды, такие как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных микросхем и печатных плат.
| Металлоиды |
| Бор B5 |
| Кремний Да 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Те 52 |
| Полоний Ро 84 |
Переходные металлы
Переходные металлы занимают группы 3-12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (через которые они соединяются с другими элементами) находятся в нескольких электронных оболочках.
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ти 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец марганец 25 |
| Железо Fe 26 |
| Кобальт Co27 |
| Никель Ni 28 |
| Медь Cu29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr40 |
| Ниобий Nb 41 |
| Молибден Мо 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Лу 71 |
| Гафний Hf 72 |
| Тантал Та 73 |
| Вольфрам W74 |
| Рений Ре 75 |
| Осмий Ос 76 |
| Иридий Ир 77 |
| Платина, часть 78 |
| Au 79 Золото |
| Меркурий ртутного столба 80 |
| Лоуренсио Lr 103 |
| Резерфордий Rf 104 |
| Дубний Дб 105 |
| Сиборгиум Sg 106 |
| Бори Бх 107 |
| Хассиум Hs 108 |
| Мейтнериум гора 109 |
| Дармштадт Дс 110 |
| Рентген Рг 111 |
| Коперник Cn 112 |
Постпереходные металлы
Они тоже «легкие». Отличаются от переходных аналогов меньшей твердостью и весом. У них разные температуры плавления и кипения. Для соединений электроны отдаются только с внешней оболочки. По степени восстановления они превосходят полуметаллы. Легкий металл выглядит как вещество с матовым покрытием, а не блестящим.
Коррозия металлов
Коррозия — самопроизвольный процесс окисления металла под действием факторов окружающей среды.
В природе практически не встречается металлов в свободном виде. Исключение составляют только «благородные», самые неактивные металлы, например золото, платина. Все остальные активно окисляются под действием кислорода, воды, кислот и др. Например, ржавчина образуется на любом незащищённом железном изделии именно в присутствии кислорода или воды. При этом окисляется железо:
а восстанавливаются компоненты атмосферной влаги:
В результате образуется гидроксид железа (II), который, окисляясь, превращается в ржавчину:
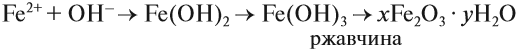
Подвергаться коррозии могут и другие металлы, правда, ржавчина на их поверхности не образуется. Так, нет на Земле металла алюминия — самого распространённого металла на планете. Но зато основу многих горных пород и почвы составляет глинозём Al2O3. Дело в том, что алюминий мгновенно окисляется на воздухе. Коррозия металлов наносит колоссальный ущерб, разрушая различные металлические конструкции.
Чтобы уменьшить потери от коррозии, следует устранить причины, которые её вызывают. В первую очередь, металлические предметы следует изолировать от влаги. Это можно сделать разными способами, например, хранить изделие в сухом месте, что далеко не всегда возможно. Кроме того, можно поверхность предмета покрасить, смазать водоотталкивающим составом, создать искусственную оксидную плёнку. В последнем случае в состав сплава вводят хром, который «любезно» распространяет собственную оксидную плёнку на поверхность всего металла. Сталь становится нержавеющей.
Изделия из нержавеющей стали дороги. Поэтому для защиты от коррозии используют тот факт, что менее активный металл не изменяется, т. е. не участвует в процессе. Поэтому если к сохраняемому изделию приварить более активный металл, то, пока он не разрушится, изделие корродировать не будет. Этот способ защиты называется протекторной защитой.































