Можно ли пить метанол?
Любая ли доза метанола губительна для человека, можно ли все-таки его пить и в каком количестве?
Употребление от 30 до 100 граммов метанола (в зависимости от физических характеристик потребителей) будет смертельным. Если же человек выжил, то в любом случае метанол, как сильнейший яд, уже успел оказать воздействие на человеческий организм.
У употребившего метиловый алкоголь происходят необратимые процессы в нервной системе, кровеносных сосудах и органах зрения, вплоть до полной слепоты. Недаром метанол изначально использовался как топливо, но и тут из-за своих характеристик не дал особо значимого эффекта.
Симптомы отравления метанолом и этанолом
Интоксикация этиловым и метиловым алкоголем также отличается своими симптомами.
Классическое отравление этиловым спиртом характеризуется головными болями, тошнотой, головокружением, желудочными расстройствами.
Человека просто «отворачивает» от дальнейшего употребления спирта — любая повторная попытка возлияния вызывает тошноту даже от запаха напитка.
Человек может отвернуться не только от употребления алкоголя, но и даже от пищи до того момента, когда не пройдут симптомы интоксикации.
Метанол же дает следующие признаки отравления:
- общие слабость и недомогание;
- резкая сильная боль в животе;
- тяжесть при дыхании, появление острой боли в грудной области;
- сильное проявление и угасание головной боли в течении некоторого промежутка времени;
- наиболее явный признак — нарушение функций зрения — начинается с размытия контуров предметов, закончиться может полной слепотой, светобоязнью и значительным расширением зрачков.
Оказание первой медицинской помощи
Любое отравление — явление для организма человека неприятное, если же это последствия употребления метанола — возможны госпитализация и летальный исход.
Поэтому, если есть малейшая вероятность, что человек отравился метиловым спиртом, следует незамедлительно вызвать скорую и провести самостоятельно ряд действий:
- Как можно быстрее сделать пострадавшему промывание желудка. Всасывание метанола в кровь происходит достаточно медленно, поэтому этот способ может замедлить пагубное влияние метанола. Добавьте в литр теплой воды пару кристаллов марганцовки до достижения раствором нежно-розового цвета. Дайте пострадавшему выпить залпом смесь, чтобы вызвать рвотный рефлекс.
- Попробуйте вышибить «клин клином» – употребление 50-100 гр этилового спирта поможет вывести из организма метанол.
- При качественной помощи медиков следует провести процедуру гемодиализа.
Прибывшие медики могут не только оказать необходимую помощь, но и назначить соответствующее лечение — на дому или в пределах стационара. В любом случае, не следует пренебрегать принятием мер, так как даже небольшие дозы метанола могут быть смертельны.
Метиловый спирт, хотя и кажется вполне безобидным, но может быть губителен и даже смертелен. При наступлении синдрома длительного сдавливания пострадавший впадает в непродолжительное состояние комы, из-за которого разрушаются мышцы, нарушается функции почечной системы, сердечные ритмы и дыхание.
Как производная пагубного влияния метанола — нарушение зрительных функций, вплоть до полной утраты зрения. Поэтому не следует пренебрегать выбором продавца алкогольных напитков. Дешево — не значит качественно и безопасно. Будьте осторожны.
Как оказать помощь при отравлении метиловым спиртом?
Первая помощь при отравлении метиловым спиртом направлена на удаление его из организма. При приеме внутрь — промывание желудка в течение первых двух часов, обильное питье, лечение щелочами (гидрокарбонат натрия — внутрь 10–15 г, внутривенно 5% раствор из расчета 7 мл на 1 кг веса тела до появления нейтральной или слабощелочной реакции мочи).
Противоядием служит этиловый спирт (понижает окисление метилового спирта и образование токсичных продуктов превращения) дают внутрь по 0,5 мл на 1 кг веса тела каждые 4 часа в течение 2–3 суток или внутривенно 5% раствор в 5% глюкозе (1 л). По показаниям— кислород, карбоген, искусственное дыхание.

Лосьон от печени. В городах России устанавливают «спиртоматы» Подробнее
Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от метанола отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140оС) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации метанола при температуре до 140оС образуется диметиловый эфир: |
2CH3-OH → CH3OCH3 + H2O
Как проверить?
Если по внешнему виду и запаху метанол практически не отличается от алкоголя с этиловой производной, как же его распознать и не подвергнуть себя негативному воздействию?
В первую очередь, покупайте только качественный алкоголь у проверенных производителей, имеющих всю необходимую документацию и лицензии. Если вы употребляете спирт медицинский или приобретенный на ликероводочном заводе, то это точно безобидный алкоголь и дело будет зависеть в количестве, а не качестве напитка.
Во-вторых, попробуйте поджечь небольшое количество напитка – суррогат, опасный для жизни, будет давать пламя зеленого цвета.
Наконец, если сомневаетесь в происхождении пробы — отдайте ее на изучение в химическую лабораторию.
Как отличить метиловый спирт от этилового?
Если вам не совсем по карману исследование свойств образца спирта в лаборатории, но вы хотите узнать какой вид спирта в стакане — метанол или этиловый, существует несколько действенных народных способов, которые помогут это определить:
- Подожгите жидкость. Мы уже говорили, что небольшая порция метанола горит зеленым цветом, этиловый же спирт даст голубые оттенки пламени. Пробу можно провести дома, налив небольшое количество спирта в блюдце, либо поджечь ватную палочку, смоченную в спиртовом растворе образца. Важный момент! Чистота реакции будет 100%, если в образце метанола отсутствуют какие-либо добавки.
- Чистим картошку. Маленький кусочек очищенного свежего картофеля необходимо бросить на несколько часов в имеющийся спиртовой образец. Если впоследствии кусочек овоща станет розовым, значит у вас в наличии опасный метанол, если синий — то в образце безобидный этиловый спирт.
- Нагрейте образец. Если у вас в наличии есть термометр со шкалой до +100 градусов, можно определить чистоту и вид спирта путем его нагрева. В металлической посуде необходимо нагреть образец и измерить температуру его кипения. Для метилового спирта она равна 64 градусам, для этилового — 78.
- Проверьте реакцию на соду и марганцовку. В прозрачной емкости смешайте образец спирта и пищевую соду в небольшом количестве, далее добавьте каплю йода. Если после смешения производных жидкость помутнела и дала осадок, то в образце — этиловый спирт, если изменила окрас, но осталась прозрачной — метиловый. Аналогичный «цветной» опыт можно провести и с кристалликами марганца — полученный раствор спирта и небольшого количества марганцовки необходимо нагреть. Если даже при небольшой температуре вы увидите появление пузырьков газа — образец опасный метанол.
- Формальдегидная проба. Для выполнения данного простейшего эксперимента вам потребуется образец тонкой медной проволоки. Если ее раскалить на огне и опустить в сосуд с пробой спирта — можно ощутить или нет резкий запах по типу яблочного уксуса. Если он появился, значит запах формалина дал ядовитый метанол, если жидкость без запаха — значит это этиловый спирт.
- Проба Ланга. Еще один нехитрый опыт с использованием марганцовки. В металлическую емкость добавляют около 50 мл спиртового образца и пару граммов марганцовки. Спирт предварительно слегка нагреваем и вливаем фиолетовый раствор перманганата калия, разведенного в дистиллированной воде. При тщательном перемешивании смесь, достигнув температуры 18-20 градусов, начнет менять свой окрас на желто-розовый. Все что вам нужно — засечь, как быстро меняется цвет смеси. Чем напиток качественнее — тем дольше проходит этот процесс. Например, медицинский этиловый спирт обесцветится за промежуток времени около 10 минут.
Существуют не только напитки с добавками, но и некоторые «таинственные» составы, где этанол может маскировать метанол.
Формалин концентрированный малометанольный представляет собой водный раствор формальдегида, который получают методом каталитического окисления и дегидрирования метанола
— Формалин, полученный на новом агрегате, будет использоваться в качестве сырья для создания параформа — продукта, который в настоящее время в России не производится и импортируется из-за рубежа. Его производство начнется на «Метафраксе» уже в следующем году. Это позволит полностью удовлетворить запросы российских потребителей в этом продукте и, в результате, снизит зависимость российской экономики от импорта, — отметил пермский губернатор Дмитрий Махонин.
По словам председателя Совета директоров «Метафракс Кемикалс» Армена Гарсляна, проделана большая совместная работа:
— Думаю, что мы еще не раз встретимся на открытии новых производств «Метафракс Групп». Мы начинаем новый пул больших инвестиций, в том числе строительство на производственной площадке в Губахе установки «Меламин-2».
Напомним, ранее стало известно, что «Метафракс Кемикалс» построит в Губахе вторую установку меламина и станет крупнейшим в России поставщиком этой продукции. Мощность нового агрегата составит 40 тыс. тонн в год. Ввод объекта в эксплуатацию запланирован на вторую половину 2025 года. Объем капитальных вложений в проект оценивается в 27,4 млрд рублей.
В стадии «горячей» пусконаладки
Ключевым проектом Группы является комплекс «Аммиак-карбамид-меламин» (АКМ). Общая стоимость — более 1 млрд евро. Проектная мощность завода позволит выпускать ежегодно до 575 тыс. тонн карбамида, 308 тыс. тонн аммиака и 41 тыс. тонн меламина. Его строительство стартовало в 2018 году и должно было завершиться в 2021 году. В интервью РБК Армен Гарслян рассказал, что сильнее всего от последствий пандемии пострадал АКМ, сроки его реализации сдвинулись:
— В мире встали все автомобильные заводы, шинные предприятия, которые являются потребителями каучуков. Также резко снизился спрос на топливо, при производстве которого используется метанол, выпускаемый в том числе и нами. Рынок продукции компании рухнул до нуля. Главной задачей стало не остановить завод, потому что метанол не кирпич, его не сложить за забором. Наши трейдеры совершили невозможное и сумели продать всю продукцию, большие объемы отгрузили на экспорт, так что мы не только не остановили завод, но и не снизили мощности по метанолу. По другим продуктам было снижение не более чем на 15%.
— На данный момент мы получили 100% импортного оборудования и полностью его смонтировали. Сейчас наша задача — до конца года закончить все строительные работы и начать пусконаладку, — рассказал топ-менеджер.
 «Метафракс Кемикалс», цех аммиака. Фото компании
«Метафракс Кемикалс», цех аммиака. Фото компании
По данным компании, строители АКМ приступили к подготовке цеха аммиака к предстоящему пуску еще в ноябре. Полностью оборудован и готов к приему жидкого продукта склад аммиака под давлением (САД). Выполнена перекачка продукта из вагонов-цистерн в шарообразные резервуары САД. Загрузка 300 тонн продукта в «шары» продолжалась 10 суток, необходимый объем продукта для пусконаладки цеха аммиака перегружен в емкости нового склада.
— Строительство цеха аммиака вошло в стадию «горячей» пусконаладки технологического оборудования, — сообщил технический директор «Метафракс Кемикалс» Александр Вдовин. — Проверены все основные узлы, а также технологическая цепочка, факельная установка и все вспомогательные системы. А на февраль, после получения необходимого объема газообразного продукта, запланирован запуск аммиачно-холодильной установки.
В декабре — январе планируется наладка и подготовка к пуску установки КЦА и компрессоров. Для контроля за этим процессом по согласованию с партнером — компанией Casale SA — на стройплощадку прибудут специалисты лицензиаров (вендоров) из компаний UOP и Mitsubishi.
— После завершения этой работы планируем пуск цеха аммиака с получением готового продукта в объеме 1500 тонн и выдачей его на склад аммиака, — заявил Александр Вдовин.
Справка
Формалин используется в производстве: синтетических смол, синтетического каучука, поверхностно-активных веществ, многоатомных спиртов и других метиленовых производных, а также в бумажной промышленности для улучшения прочности и качества бумаги; в кожевенной — для дубления кожи; в текстильной — для повышения сопротивляемости изделий к сминанию и усадке; в сельском хозяйстве — для обработки семян и корнеплодов, дезинфекции почвы и животноводческих помещений; в медицине — в качестве дезинфицирующего средства.
Новости
17/7/2020

Пермская галерея и «Метафракс» развивают сотрудничество
Пермская художественная галерея и «Метафракс» начинают реализацию совместного выставочного проекта «Внутри картины». Это современная выставка для детей, сочетающая произведения искусства, доступность информации, запоминающуюся экспозицию, интерактивность, совмещение разных форм восприятия: зрительной, тактильной, слуховой.
Большая коллекция живописи в собрании галереи позволит показать яркие и запоминающиеся произведения искусства, а внедрение современных мультимедийных форм сделает выставку информационно насыщенной и легко воспринимающейся. Проект реализуется при поддержке бенефициарного владельца ПАО «Метафракс» Сейфеддина Рустамова.
«Особенность этой выставки в том, что она будет соответствовать представлениям детей об «идеальной выставке». Для этого мы проводили специальный опрос наших юных зрителей. Здесь будет можно и нужно смотреть, исследовать, размышлять, задавать вопросы, искать ответы, интерпретировать. Будет и новое, что еще никто не делает: дети смогут заняться творчеством прямо в экспозиции, не создавая при этом рисков для экспонатов: рисовать в воздухе, с помощью веб-камеры и монитора, с использованием программы, распознающей движения руки. Это позволяет рисовать жестами, переводить движение в цветовые воплощения и сохранять то, что создал ребенок на телефон или планшет, — рассказала заместитель директора по науке Пермской художественной галереи Ольга Старцева.
По ее словам, важный дополнительный формат выставки – четырехсерийный мультфильм, главным героем которого является юный художник. Также будет подготовлен виртуальный тур для тех, кто далеко, а также для детей и взрослых с ограниченными возможностями здоровья. Путешествие по выставке сопровождается рассказом музейного педагога о том, как и почему создается картина, какие бывают технологии, как научиться видеть невидимое. Выставка откроется в декабре нынешнего года.
«Пермскую галерею» и «Метафракс» объединяют давние и продуктивные партнерские отношения, которые являются ярким примером взаимодействия крупного индустриального бизнеса со сферой культуры. Мы изначально планировали, что выставка будет интерактивной. Сегодня, в условиях ограничений в связи с пандемией, это решение оказалось очень своевременным и актуальным, — комментирует советник председателя Совета директоров ПАО «Метафракс» Мария Коновалова. Планируется, что после закрытия выставки в Перми, она будет экспонироваться в Губахинском историко-краеведческом музее. Показать наследие «Пермской галереи» в Губахе – хорошая возможность для развития культурного потенциала города».
Выставка станет продолжением другого совместного проекта Пермской галереи и «Метафракса» — «Химия живописи». Проект реализовывался в 2019 году. Его целью было рассказать юным зрителям о невозможности существования искусства без науки на примере техники живописи, знание и владение которой является обязательной для каждого художника.
Получение[править | править вики-текст]
Известно несколько способов получения метанола: сухая перегонка древесины и лигнина, термическое разложение солей муравьиной кислоты, синтез из метана через метилхлорид с последующим омылением, неполное окисление метана и получение из синтез-газа. Первоначально в промышленности был освоен метод получения метанола сухой перегонкой древесины, но впоследствии он потерял своё промышленное значение. Современное производство метанола из монооксида углерода и водорода впервые было осуществлено в Германии компанией BASF в 1923 году. Процесс проводился под давлением 25—35 МПа на цинк-хромовом катализаторе (ZnO/Cr2O3) при температуре 320—450 °C. Впоследствии распространение получил синтез метанола на медьсодержащих катализаторах, промотированных цинком, хромом и др., при 200—300 °C и давлении 3,5—5,5 МПа, разработанный в Англии.
Современный промышленный метод получения — синтез из оксида углерода(II) и водорода на медь-цинковом оксидном катализаторе при следующих условиях:
- температура — 250 °C,
- давление — 7 МПа (= 70 атм = 70 Бар = 71,38 кгс/см²)
Схема механизма каталитического получения метанола сложна и суммарно может быть представлена в виде реакции:
+ 2 → CH3OH
До промышленного освоения каталитического способа получения метанол получали при сухой перегонке дерева (отсюда его название «древесный спирт»). В данное время этот способ не актуален.
Молекулярная формула — CH4O или CH3—OH, структурная:
Производство метанола (в тыс. тон):
| год | 1928 | 24 | 18 | 140 | 84,7 |
| 1936 | 97 | 93 | 305 | 88,9 | |
| 1950 | 360 | 120 | 349 | 83,1 | |
| 1960 | 892 | 297 | 3930 | 99,7 | |
| 1970 | 2238 | нет данных | 5000 | 89,7 | |
| 1980 | 3176 | 870 | 15000 | 236,1 | |
| 2004 | 3700 | 2000 | 32000 | 270 |
Окисление метанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Метанол окисляется сначала в формальдегид, затем в углекислый газ:Метанол → формальдегид → углекислый газ |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол < первичные спирты < вторичные спирты < третичные спирты
4.1. Окисление оксидом меди (II)
Метанол можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Метанол окисляется до метаналя.
| Например, метанол окисляется оксидом меди до муравьиного альдегида |
CH3-OH + CuO → CH2O + H2O + Cu
4.2. Окисление кислородом в присутствии катализатора
Метанол можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Метанол окисляется до метаналя.
2CH3-OH + O2 → 2CH2=O + 2H2O
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) метанол окисляется до углекислого газа.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ |
4.4. Горение метанола
При сгорании спиртов образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2n+1ОН + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
| Например, уравнение сгорания метанола: |
2CH3OH + 3O2 = 2CO2 + 4H2O
Свойства метанола и его реакции[править | править вики-текст]
При написании этой статьи использовался материал из Энциклопедического словаря Брокгауза и Ефрона (1890—1907).
Метанол — бесцветная жидкость с алкогольным запахом (запах этилового спирта). Температура кипения 64,7°.
Удельный вес при 0°/0° = 0,8142 (Копп); при 15°/15° = 0,79726; при 25°/25° = 0,78941 (Perkin); при 64,8°/4° = 0,7476 (Шифф); при 0°/4° = 0,81015; при 15,56°/4° = 0,79589 (Dittmar и Fawsitt). Капиллярная постоянная при температуре кипения a ² =5,107 (Шифф); Критическая температура 241,9° (Шмидт).Упругость пара при 15° = 72,4 мм; при 29,3° = 153,4 мм; при 43° = 292,4 мм; при 53° = 470,3 мм; при 65,4° = 756,6 мм (Д. Коновалов). Теплота горения равна 170,6, теплота образования 61,4 (Штоман, Клебер и Лангбейн).
Метанол смешивается во всех отношениях с водой, этиловым спиртом и эфиром; при смешении с водой происходит сжатие и разогревание. Горит синеватым пламенем. Подобно этиловому спирту — сильный растворитель, вследствие чего во многих случаях может заменять этиловый спирт. Безводный метанол, растворяя небольшое количество медного купороса, приобретает голубовато-зеленое окрашивание, поэтому безводным медным купоросом нельзя пользоваться для открытия следов воды в метаноле; но он не растворяет CuSO4∙7H2O (Клепль).
Метанол (в отличие от этанола) с водой не образует азеотропной смеси, в результате чего смеси вода-метанол могут быть разделены ректификационной перегонкой. Температура кипения водных растворов метанола:
Methanol Mole %
Т_кип, 760 мм.рт.ст. °C
| 100 | |
| 5 | 92.8 |
| 10 | 88.3 |
| 15 | 84.8 |
| 20 | 82 |
| 25 | 80.1 |
| 30 | 78.2 |
| 35 | 76.8 |
| 40 | 75.6 |
| 45 | 74.5 |
| 50 | 73.5 |
| 55 | 72.4 |
| 60 | 71.6 |
| 65 | 70.7 |
| 70 | 69.8 |
| 75 | 68.9 |
| 80 | 68 |
| 85 | 67.1 |
| 90 | 66.3 |
| 95 | 65.4 |
| 100 | 64.6 |
Метанол дает со многими солями соединения, подобные кристаллогидратам (сольваты), например: CuSO4 ∙ 2СН3ОН; LiCl ∙ 3СН3ОН; MgCl2 ∙ 6СН3ОН; CaCl2∙ 4СН3ОН представляет собой шестисторонние кристаллы, разлагаемые водой, но не разрушаемые нагреванием до 100° (Kane). Соединение ВаО ∙ 2СН3ОН ∙ 2Н2O получается в виде блестящих призм при растворении ВаО в водном метаноле и испарении на холоде полученной жидкости при комнатной температуре (Форкранд).
С едкими щелочами метанол образует соединения 5NaOH ∙ 6СН3ОН; 3KOH ∙ 5СН3OH (Геттиг). При действии металлических калия и натрия легко даеталкоголяты, присоединяющие к себе кристаллизационный метанол и иногда воду.
При пропускании паров метанола через докрасна накаленную трубку получается C2H2 и др. продукты (Бертло). При пропускании паров метанола над накаленным цинком получается окись углерода, водород и небольшие количества болотного газа (Jahn). Медленное окисление паров метанола при помощи раскаленной платиновой или медной проволоки представляет лучшее средство для получения больших количеств формальдегида: 2СН3ОН+О2=2НСНО+2Н2О. При действии хлористого цинка и высокой температуры метанол дает воду и алканы, а также небольшие количествагексаметилбензола (Лебедь и Грин). Метанол, нагретый с нашатырем в запаянной трубке до 300°, дает моно-, ди- и триметиламины (Бертло).
При пропускании паров метанола над KOH при высокой температуре выделяется водород и образуются последовательно муравьинокислый, щавелевокислый и, наконец, углекислый калий.
Концентрированная серная кислота дает метилсерную кислоту CH3HSO4, которая при дальнейшем нагревании с метанолом дает метиловый эфир. При перегонке метанола с избытком серной кислоты в отгон переходит диметилсерная кислота (CH3)2SO4. При действии серного ангидрида SO3 получается CH(OH)(SO3H)2 и CH2(SO3H)2 (см. Метилен).
Метанол при действии соляной кислоты, пятихлористого фосфора и хлористой серы дает хлористый метил СН3Cl. Действием HBr и H2SO4 получают бромистый метил. Подкисленный 5%-й серной кислотой и подвергнутый электролизу, метанол дает СО2, СО, муравьинометиловый эфир, метилсерную кислоту и метилаль СН2(ОСН3)2 (Ренар). При нагревании метанола с хлористо-водородными солями ароматических оснований (анилином, ксилидином, пиперидином) легко происходит замещение водорода в бензольном ядре метилом (Гофман, Ладенбург); реакция имеет большое техническое значение при приготовлении метилрозанилина и других искусственных пигментов.
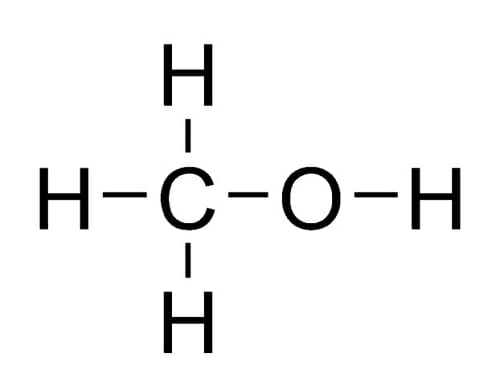
Структура метанола
Метанол состоит из спиртовой группы «ОН», присоединенной к одному атому углерода. Оставшиеся пятна связи атома углерода заняты тремя атомами водорода. Эта структура показана ниже:
Метанол тесно связан с этанолом, или «зерновым спиртом». Этанол – это алкоголь, содержащийся в пиве, вине и ликере.
Когда «мет» относится к одному углероду, насыщенному атомами водорода, префикс «этил» относится к цепочке из двух атомов углерода, насыщенной атомами водорода. Этанол, следовательно, имеет цепочку из двух атомов углерода, где метанол имеет один.
Этот дополнительный углерод очень сильно влияет на то, как наш организм усваивает спирты. Хотя этанол безопасен для употребления в умеренных количествах, метанол расщепляется нашими печенками до формальдегида – высокотоксичного продукта, который может вызвать слепоту, повреждение нервов и смерть.
Поскольку метанол и этанол производятся с помощью одинаковых химических и микробных процессов, при ферментации и перегонке необходимо соблюдать особую осторожность, чтобы не загрязнять спиртовой спирт метанолом
Что представляет собой метиловый спирт?
Метанол — технический вид алкоголя, может смешиваться с водой абсолютно в любых пропорциях и на внешний вид не будет отличаться от спирта этилового, если не исследовать его более детально.
К свойствам и характеристикам метанола относят:
- отсутствие цвета;
- легкость воспламенения;
- вкусовые характеристики и запах идентичны с этанолом;
- способность растворяться и взаимодействовать не только с водой, но и в растворителях органического типа – эфирах сложного плана и бензоле;
- закипает при нагреве до 64 градусов.
В 20-х годах века 20-го метанол стал синтезироваться и производиться уже в промышленных масштабах.
Формула
С точки зрения химии метиловый (технический) алкоголь — одноатомный, имеет свойства как у слабой кислоты, в результате взаимодействия с парами воды (при наличии катализатора) дает двуокись углерода и смесь водорода.
При очищении данной смеси от углекислой составляющей получается практически чистый (98%) водород. При взаимодействии с кислотами образует сложные эфирные смеси, а с металлами типа натрия, калия и других — метилаты.
Классической химической формулой метанола будет CH3OH, масса молекулярная соответствует характеристике 32 моль, плотность вещества — порядка 0,7918 см3. Помимо закипания при нагреве до 64 градусов Цельсия, вещество будет плавиться при достижении температуры в 97 градусов.
Терапия отравления метанолом
Отравление метанолом является опасным состоянием, которое требует быстрой диагностики и лечения. Первостепенная цель терапии — максимально уменьшить влияние спирта на организм.
Вообще о лечении
Лечение следует начинать, даже раньше, чем будет поставлен окончательный диагноз.
· Промывание желудка. Оно показано, если прошло < 2 часа с момента приема.
· Коррекция ацидоза. Выполняется с гидрокарбонатом натрия и изначально является наиболее важным наряду с поддержкой жизненно важных функций, таких как дыхание и кровообращение.
· Ингибирование алкогольдегидрогеназы с помощью этанола или противоядия фомепизола.
· Удаления метанола и муравьиной кислоты гемодиализом. Это чаще всего делается параллельно.
Состав медицинского спирта (этилового)
Этиловый спирт можно употреблять внутрь в разбавленном виде, он является органическим веществом, состоящим из углерода, водорода и кислорода. Он представляет собой простой одноатомный спирт, то есть с одной гидроксильной группой ОН, его химическая формула CH3CH2OH.
По физическим свойствам этанол – бесцветная прозрачная жидкость с характерным резким запахом и жгучим вкусом, легче воды, с плотностью 0,7893 г/см3 (1 литр этилового спирта = 789 граммам по весу), температурой кипения 78,39°С. Он хорошо растворяется в воде, присоединяя к себе ее молекулы, легко смешивается со многими веществами, вступая с ними в химические реакции, что делает его растворителем органических веществ, в том числе и жиров.
Этанол находит применение в химическом производстве, используется в качестве ракетного топлива, широко применяется в медицине, пищевой и парфюмерно-косметической промышленности, в быту. По действию на организм этиловый спирт (этанол, винный спирт, медицинский спирт) квалифицируется как наркотик, а продукты его распада являются умеренно токсичными для всех органов.
Спирт очень горюч, легко воспламеняется в присутствии кислорода и горит синим пламенем. Характерна также летучесть – высокая способность к испарению, если он хранится в негерметичной таре. Его пары в смеси с кислородом представляют собой взрывоопасную смесь.



























